即便最有效的藥物,也有可能出現耐藥問題,在腫瘤治療領域,化療也是如此。該如何克服化療耐藥是一直是腫瘤研究領域的熱點和難點問題。基於多組學測序數據尋找治療靶點,並在患者腫瘤來源的模型中進行藥物試驗驗證,是現時開發靶向藥物的有效手段之一。
近日,中山六院吳小劍課題組與中山大學腫瘤防治中心譚靜課題組利用組學測序數據綜合挖掘出結直腸癌化療耐藥的潜在相關靶點PLK1,並在多個患者腫瘤來源的模型上進行了藥物試驗驗證,系統地探索了PLK1抑制劑在結直腸癌中的治療機制。結果發現聯合使用PLK1抑制劑能顯著提高奧沙利鉑抗腫瘤作用,這為化療耐藥或者腫瘤復發的腸癌患者提供了新的治療思路。相關研究成果發表在最新一期《Advanced Science》(高等科學雜誌)。

腸癌化療耐藥導致腫瘤無限制生長
腸癌的化療耐藥是臨床治療中無法回避的問題,相當一部分患者在經過腸癌的根治性治療後,卻因化療耐藥而發生腫瘤復發和轉移,最後因無藥可用而導致腫瘤無限制地播散生長。
為了挖掘克服化療耐藥的潜在治療靶點,研究團隊首先對54例結直腸癌腫瘤組織和配對的癌旁黏膜組織的基因晶片數據進行綜合分析,發現PLK1訊號通路過度活化,提示PLK1可能是結直腸癌的有效治療靶標。此外,研究團隊在343例結直腸癌病人隊列中對PLK1和p-PLK1的表達情况及對應的預後進行分析,發現高表達PLK1和p-PLK1的患者腫瘤復發率較高,生存期更短。
研究團隊進一步收集了27例結直腸癌患者在化療前和腫瘤復發後的配對樣本,發現腫瘤復發後PLK1和p-PLK1表達顯著增高,提示可能與腫瘤的化療耐藥相關。同時PLK1抑制劑可顯著增强奧沙利鉑對腫瘤細胞的抑制效果,這一錶型在結直腸癌細胞系、患者腫瘤來源的類器官模型及PDX模型上得到驗證。為探索其藥理機制,研究者通過綜合分析RNA-seq和ChIP-seq數據,發現CDC7可能是PLK1抑制劑增敏奧沙利鉑藥效的重要下游分子,c-MYC可通過轉錄調控CDC7而發揮關鍵調控作用,提示PLK1-MYC-CDC7訊號通路可能在調控結直腸癌化療耐藥中發揮重要功能。
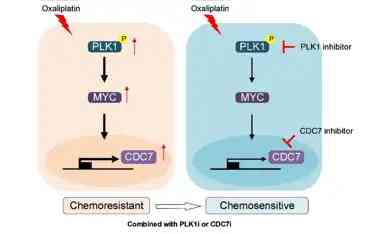
靶向抑制PLK1-MYC-CDC7訊號通路可以有效提高奧沙利鉑敏感性的治療策略
大規模資料分析,發現潜在藥物靶點
研究團隊通過綜合分析大規模結直腸癌患者樣本數據,發現PLK1可能是結直腸癌的潜在藥物靶點。並發現化療後復發的患者腫瘤組織中PLK1高表達,提示可能與化療耐藥相關。
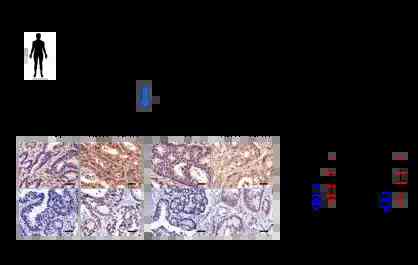
化療後復發的患者腫瘤組織中PLK1高表達
為了驗證藥物療效,研究團隊在結直腸癌細胞系、患者腫瘤來源的類器官模型及PDX模型上進行藥效實驗,證實該靶向藥物可提高奧沙利鉑療效,為臨床轉化治療提供了充足的臨床前研究數據。
靶向治療在類器官及PDX模型上具有顯著藥效
通過綜合分析RNA-seq和ChIP-seq數據,發現PLK1-MYC-CDC7訊號通路在調控結直腸癌化療耐藥中發揮重要功能,為PLK1抑制劑的臨床運用提供了明確的藥理機制。

PLK1抑制劑與奧沙利鉑聯合使用的藥理機制
研究團隊探究了PLK1抑制劑在結直腸癌中的治療潜能,闡明了PLK1抑制劑與奧沙利鉑聯合使用的藥理機制,即PLK1抑制劑可以通過抑制c-MYC對CDC7的轉錄活性,進而導致CDC7的蛋白水准下調,並最終提出了靶向抑制PLK1-MYC-CDC7訊號通路可以有效提高奧沙利鉑敏感性的治療策略。
中山大學附屬第六醫院吳小劍主任醫師、中山大學腫瘤防治中心譚靜研究員和中山大學附屬第六醫院蘭平教授為本論文的通訊作者,餘照亮博士後、鄧鵬博士以及陳鈺鋒主治醫師為本文的共同第一作者,本研究還得到了新加坡基因組研究院於强教授的大力支持。
采寫:南都記者王道斌通訊員簡文楊戴希安餘照亮
評論留言