編譯:陳康中國人民解放軍總醫院內分泌科
前言:近期,美國心臟協會(AHA)發佈了新的防治高血壓减重策略,提出了以下幾種途徑來達成减重目標:
飲食控制
體育活動
藥物治療
代謝手術

肥胖、高血壓和心臟代謝風險流行病學
根據最近公佈的估計,美國有近一半(45%)的成年人患有高血壓,定義為收縮壓(SBP)≥130 mm Hg,舒張壓(DBP)≥80 mm Hg,或正在服用抗高血壓藥物。高血壓是導致死亡率上升、慢性腎病和心血管疾病(CVD)的主要原因,包括心肌梗死、心力衰竭和中風。體重增加和肥胖是高血壓的主要危險因素,常與高血壓同時發生;囙此,有意的體重減輕策略代表了降低患有超重/肥胖和高血壓的個體的慢性病風險和死亡率的理想目標。
內臟型肥胖(而非皮下型肥胖)的新增與偶發高血壓有很大關係。隨著全球肥胖患病率的新增,高血壓患病率預計將新增。根據世界衛生組織的估計,2016年> 10億成年人超重,其中> 6.5億人患有肥胖症。2017年至2018年,美國成年人嚴重肥胖的患病率為9.2%,僅10年就新增38%。此外,兒童和青少年的肥胖和超重患病率急劇上升,在全球範圍內影響了> 18%。囙此,與超重相關的高血壓是一個日益嚴重的問題,將顯著影響全球的醫療保健系統。
如果持續减重,通過飲食干預或新增體力活動(PA)進行的有意减重可產生具有臨床意義的血壓(BP)下降。然而,從長遠來看,這些减重策略可能具有挑戰性。當與生活方式改變相結合時,抗肥胖藥物治療和代謝手術(metabolic surgery,MS)可以成為適當肥胖患者减重和BP控制的有效長期解決方案。肥胖治療的循證指南和科學聲明已在之前發佈。
肥胖對高血壓的影響靶器官損傷
肥胖和高血壓都與脈管系統、心臟、腎臟和大腦中的靶器官損傷密切相關。來自大規模隊列研究的證據表明,更肥胖與發生心力衰竭、冠心病和中風的更高風險之間存在明顯的劑量反應關係。此外,在對39項隊列研究的參與者進行的患者水准薈萃分析中,Chang等發現,體重指數(BMI)為40kg/m2與體重指數為25 kg/m2相比,發生腎功能下降或終末期腎病的風險高2倍。與常規護理相比,歸因於MS的顯著體重減輕與腎臟高灌注、蛋白尿以及重大不良CVD事件和終末期腎病的風險降低相關。
在對高血壓進行調整後,肥胖與靶器官損害風險之間的關係消失,這表明高血壓是肥胖中靶器官損害的一個關鍵解釋因素。在收縮壓干預試驗(the Systolic Blood Pressure Interven-tion Trial)的一項事後分析中,較高的BMI與强化BP控制對CVD事件的差异效應無關。儘管如此,高血壓的適當管理對於减少肥胖對靶器官的不良影響仍然至關重要。
肥胖高血壓的病理生理學
肥胖性高血壓的病理生理學是多因素的,具有高度的時間依賴性(圖1)。過量餵食人類和實驗動物會迅速啟動交感神經系統(sympathetic nervous system,SNS)和腎素-血管緊張素-醛固酮系統(RAAS),甚至在體重大幅增加之前就已啟動。相反,在大多數肥胖患者(包括2型糖尿病患者)中,由於自願限食或MS導致的熱量攝入减少會迅速降低BP並減輕代謝紊亂。雖然伴隨體重增加的BP新增最初是輕度的,但對於慢性肥胖患者而言,靶器官會逐漸受到損傷,從而加重高血壓。肥胖對BP的長期影響也取決於多餘脂肪的儲存位置,內臟脂肪比皮下脂肪更容易引發高血壓。
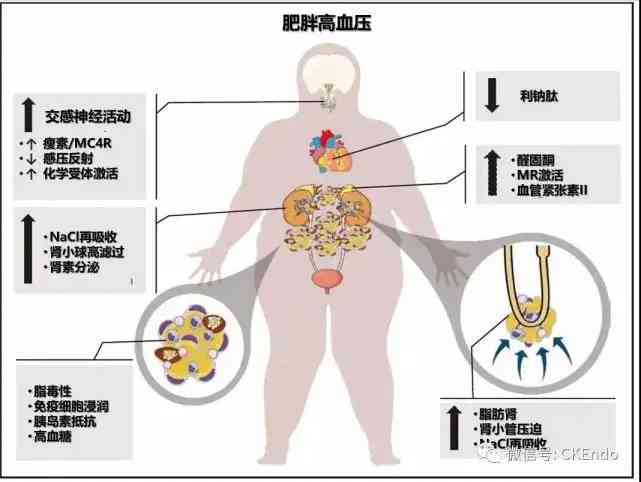
圖1肥胖對血壓升高的影響
肥胖對血壓升高的影響是多因素的,包括神經激素改變、脂肪對腎臟的物理壓迫、腎臟氯化鈉(NaCl)重吸收新增以及炎症。代謝异常和炎症與高血壓相互作用,導致腎損傷並加劇血壓升高。
MC4R表示黑皮質素4受體;MR為鹽皮質激素受體。
引發肥胖性高血壓的機制
肥胖會導致許多組織的細胞外液體容積擴張和血流量新增,從而導致靜脈回流和心輸出量新增。體積膨脹是由腎小管鈉重吸收的新增介導的,因為腎血流量和腎小球濾過率最初在肥胖發生期間升高,即腎損傷之前。
至少有3個主要因素導致鈉重吸收新增:
RAAS啟動,包括鹽皮質激素受體刺激;
SNS啟動,尤其是腎交感神經活性增高;
通過內臟、腹膜後和腎竇脂肪的腎壓迫。
其他幾個因素也被視為肥胖性高血壓的潜在介質,包括胰島素抵抗、炎症、利鈉激素缺乏、腸道微生物群改變和血管周圍脂肪組織新增。然而,這些機制在引發肥胖性高血壓中的重要性仍不清楚。
1. SNS(交感神經系統)啟動
肥胖會導致SNS啟動,在各種組織中受到不同程度的控制,並且主要與內臟肥胖新增有關。SNS活性新增通常是輕度的,不會降低組織血流量,但足以新增腎鈉重吸收和腎素釋放。在實驗性肥胖以及治療耐藥的肥胖患者中,去腎神經支配可顯著減輕高血壓。
多種因素導致肥胖患者交感神經活化,包括:
應激反射功能障礙、
缺氧
化學受體活化,尤其是在睡眠呼吸暫停患者中。
瘦素是一種與肥胖程度成比例分泌的脂肪因數,在肥胖性高血壓中也刺激SNS活性,主要是通過啟動前黑皮質素神經元,進而啟動大腦黑皮質素4受體。
2. RAAS啟動
與內臟肥胖相關的多種機制啟動了RAAS效應,包括腎臟受壓和SNS啟動新增。實驗和臨床研究表明,RAAS阻斷劑可有效降低肥胖受試者的BP,儘管血管緊張素II僅輕度升高,表明對血管緊張素II的敏感性新增。即使血漿醛固酮正常或低於正常水准,鹽皮質激素受體的拮抗作用也可降低肥胖性高血壓患者的BP並減輕靶器官損傷,這表明鹽皮質激素受體的啟動至少部分獨立於醛固酮。
3.腎臟壓迫
隨著內臟脂肪、腎周脂肪和腎竇脂肪的積聚以及腹內壓的升高,腎臟變得受壓,進一步啟動了RAAS效應,新增了鈉的重吸收,並促使由SNS引發的BP升高。
4.炎症、代謝紊亂和進行性心腎損害加劇肥胖性高血壓
內臟肥胖會引發包括腎臟在內的全身脂肪組織和器官的炎症反應,這是由於常駐巨噬細胞的啟動、巨噬細胞的分解以及局部和旁分泌/內分泌管道的促炎細胞因數分泌所致。肝臟、骨骼肌、腎臟、血管和其他器官中的异比特脂質積聚會導致“脂肪毒性、炎症和一系列代謝紊亂,包括血脂异常、胰島素抵抗、葡萄糖耐受不良和2型糖尿病(隨時間推移)”。這些慢性炎症和代謝疾病與血壓升高相互作用,在血管、心臟和腎臟中引起氧化應激、內質網應激和線粒體功能障礙。
在肥胖早期,存在輕度至中度腎纖維化、微量白蛋白尿、系膜基質擴張、腎小球肥大、局灶節段性腎小球硬化和足細胞損傷,並伴有腎小球濾過率升高(腎小球濾過率升高)。隨著肥胖、高血壓、代謝和炎症性疾病持續多年,腎小球濾過率降低,取而代之的是腎小球濾過率下降和與腎組織損失相關的BP鹽敏感性新增。肥胖還會加重其他原發性腎臟損害的有害影響,例如單側腎臟切除、腎臟移植和免疫球蛋白A腎病[31]。隨著腎功能下降,高血壓變得更加嚴重,適當的BP控制變得更加困難,全身的心臟和血管損傷也在加重。
飲食對持續體重減輕和高血壓控制的影響
幾項國家指導方針建議單獨或作為整體健康生活管道的一部分進行心臟健康飲食,以控制高血壓、控制體重和降低CVD風險。當前的飲食指導方針強調基於飲食模式的方法,而不是針對CVD預防和控制的單獨食物和營養素。
最成熟的健康飲食模式是:
地中海飲食(Mediterranean diet)
封锁高血壓的飲食方法(Dietary Approaches to StopHypertension,DASH)。
這兩種飲食模式同樣富含水果、蔬菜、豆類、堅果和種子,攝入適量水果、海鮮、家禽和乳製品,攝入少量紅肉和加工肉及糖果。地中海飲食還提倡大量使用橄欖油,經常但適度地飲用葡萄酒(尤其是紅酒)。
1.地中海飲食
2019年Cochrane隨機對照試驗綜述(RCT)發現,地中海飲食對SBP(3.0mm Hg[95% CI,-3.5至-2.5])和DBP(-2.0 mm Hg [95% CI,-2.3至-1.7])有顯著的有益影響。對16個RCT的薈萃分析發現,地中海飲食干預還能減輕體重(-1.8 kg [95% CI,-2.9至-0.6]).
2. DASH飲食
與地中海飲食相比,DASH飲食似乎能提供更强的降低血壓作用。在一項對24項飲食模式干預RCT的薈萃分析中,DASH飲食對降低SBP病(-7.6mm Hg[95% CI,-10.0至-5.3])和DBP(-4.2mmHg[95% CI,-5.9至-2.6])有很大作用。當與减重和運動干預相結合時,DASH飲食比DASH單獨飲食(-11.2/7.5)顯著降低BP(-16.1/9.9mm Hg)。在DASH鈉試驗中,與高鈉攝入量(3450 mg/d)的DASH飲食相比,低鈉攝入量(1150 mg/d)的DASH飲食使SBP降低了0.9mm Hg(95% CI,-2.1至-0.3)、3.3mm Hg(95% CI,-4.7至-1.9)、4.9mm Hg(95% CI,-7.3至-2.6)和10.4mm Hg(95% CI-15.5至-10.4)。
獨立於飲食模式,低鈉攝入也有利於BP控制。在一項針對133個RCT的薈萃回歸分析中,鈉攝入量减少2300mg/d與SBP减少7.7mmHg(95% CI,-10.4至-5.0)和BP>131/78 mm Hg的人群中DBP减少3.0mmHg(95% CI,-4.6至-1.4)有關。此外,薈萃分析結果顯示24小時尿鈉每减少50 mmol(鈉攝入的客觀名額SBP降低1.1mmHg(95%CI,0.7–1.5)。鈉减少對BP的影響在年齡較大、高血壓和黑人個體中似乎尤為明顯。鉀消耗量新增也與BP降低有關,但過量攝入鉀與不良結果有關。
3.間歇性禁食/輕斷食
除了這些被廣泛推薦的改善飲食組成和質量的方法之外,一些研究還調查了可减重和控制血壓的進食時間。對代謝綜合征患者進行的小型臨床研究表明,間歇性禁食可能會使SBP和DBP適度降低,與通過其他干預措施减重所實現的降低相似。對4項隨機對照試驗的系統審查表明,但間歇性禁食對短期體重減輕有效,但對BP降低的影響較弱[51]。對6項隨機對照試驗的另一項系統審查和薈萃分析表明,間歇性禁食對體重減輕(4.1kg[95%CI-2.0至-6.3])比無治療更有效,但與持續能量限制(-1.0kg[95%CI-2.5至0.4])沒有顯著差异。間歇性禁食對BP控制的影響需要進一步研究。
PA(體育活動)對持續减重的影響以及PA降低血壓的高血壓控制機制
PA被定義為通過骨骼肌的收縮產生的身體運動,其將能量消耗新增到高於靜息水准。鍛煉是中度至劇烈强度的PA,具有計劃性、結構化和重複性,旨在改善或維持健康。久坐行為,其特徵是在坐姿或臥姿下能量消耗≤1.5代謝當量(metabolic equivalents),被認為是一種與中度或重度PA所用時間不同的構造,因為兩者均與全因死亡率獨立相關。錶1顯示了可能成為較高PA水准對BP和心臟代謝風險的益處基礎的擬議機制。

1.PA對肥胖性高血壓的影響
有證據表明,PA和運動訓練(ET)可降低肥胖、BP和肥胖高血壓。儘管發現CVD風險因素改善,體重減輕僅2%至3%,但現時的建議是在6個月內至少減輕5%至10%(具有臨床意義的體重減輕),因為主要CVD風險因素(包括血脂)和其他相關心臟代謝風險因素(包括胰島素敏感性、動脈僵硬度和靜息血壓)都有更深刻的改善。ET(運動訓練)對血壓的影響也很顯著,與體重無關。最近,Noone等對93個RCT進行了薈萃分析,ET和藥物治療均有效降低了BP。雖然點估計比ET更傾向於藥物治療,但這些差异沒有統計學意義。由於其成本低,無主要不良作用或藥物相互作用,除了ET對改善心肺功能水准的影響(可能是最强的CVD風險標誌物之一)外,ET應成為所有抗高血壓和减重工作的一部分。
體重減輕5%至10%可分別使SBP和DBP降低> mm Hg和mm Hg,體重減輕10 kg可使SBP降低5-20mmHg。通常,
2.减少久坐以降低血壓
有强有力的證據表明,PA干預可降低BP。對26項研究的系統回顧表明,計步器新增了成年門診患者的PA,降低了SBP和DBP。來自干預研究的越來越多的證據表明,减少久坐(即,减少或中斷步行或站立休息的坐著時間)會導致SBP或DBP降低1至16 mmhg。患有高血壓的個體與沒有患有高血壓的個體相比,坐著時間中斷的BP降低幅度可能更大。由於PA和坐位之間的複雜關係,指南現時不推薦一個特定的處方來說明為了觀察到血壓降低,應該减少多少坐位時間。
高累率和飲食鍛煉對血壓控制的長期療效降低
儘管飲食改變、鍛煉和相關的體重減輕是降低BP的有效策略,但在接受此類生活方式干預的人群中,高血壓的復發率較高。根據對前瞻性試驗的審查,隨著時間的推移,體重減輕對BP的有益影響顯著降低或逆轉。這種累犯大多與體重恢復的常見情况有關。例如,TOHP II期研究(高血壓預防試驗)表明,在血壓中度升高的成人中,體重減輕或鈉攝入量减少會降低血壓,儘管這種影響會隨著時間的推移而减弱。對體重減輕組中的TOHP-II進行的事後分析表明,與被隨機分配到常規護理對照組的參與者相比,那些保持體重減輕的人患高血壓的可能性低65%。體重減輕的幾種複雜的生理適應促進了體重的恢復,包括歸因於較低靜息代謝率的能量效率新增和能量消耗减少,以及激素變化導致的飽腹感降低。囙此,多年來成功的體重減輕維持通常需要高水准的PA和有限的久坐時間、頻繁的體重監測和高水准的飲食限制。
在接受生活方式干預的患者中,血壓的反復升高也部分與體重恢復無關。例如,對持續9周的每日800卡路里飲食的反應,34名男性和女性的體重從平均101.7下降至87.3kg(–14.4kg),24小時動態SBP從130.1mm Hg下降至121.1mm Hg(–9mm Hg)。然而,儘管在6個月時體重完全維持下降,平均24小時SBP上升至126.5mm Hg(–3.6mmHg),為初始反應的40%同樣,儘管約88%的初始體重減輕在第1年得以維持(–12.6kg),但SBP升高至127.9 mm Hg(自基線變化–2.2mm Hg,約為初始BP應答的24%)。在减重過程中,一些促進BP降低的生理變化(包括SNS活性和血漿腎素活性降低)即使在持續减重的受試者中也是短暫的。這表明通過改變生活方式實現减重的受試者中,對减重的非持續神經激素反應可能進一步導致高血壓的復發。
藥物治療
1.美國食品與藥物管理局準予的减重藥物
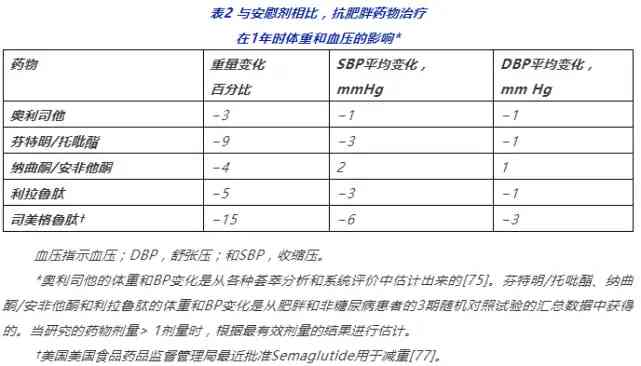
對於僅對生活方式改變有有限治療反應且BMI≥30 kg/m2或BMI≥27 kg/m2且存在體重相關合併症(如高血壓)時的患者,可考慮採用藥物治療進行體重管理。抗肥胖藥物治療旨在作為飲食和運動的輔助治療。美國美國食品藥品監督管理局食品和藥物管理局(FDA)準予了四種僅用於短期(最長12周)肥胖治療的藥物療法:芬特明(phentermine)、二乙胺苯丙酮;(安非拉酮/diethylpropion)、苯甲曲秦(phendimetrazine)和苄非他明(甲苯异丙胺/benzphetamine)。這些藥物與苯丙胺(amphetamine/安非他明)有著密切的結構和機制關係。現時,有5種藥物療法被FDA準予用於長期减重:奧利司他、芬特明/托吡酯緩釋、納曲酮/安非他酮、利拉魯肽3.0mg和司美格魯肽(semaglutide)2.4 mg,每週皮下給藥。奧利司他的主要作用機制是减少腸內脂肪吸收。芬特明/托吡酯、納曲酮/安非他酮和利拉魯肽是增强飽腹感和减少饑餓的中樞作用藥物。在RCT中,獲准長期使用的藥物(以及生活方式改變)在1年內比安慰劑(以及生活方式改變)平均减少3%-9%的體重。開始藥物治療後前3至4個月內的體重減輕是對這些藥物1年反應的最一致預測因素,可作為繼續藥物治療而不是改用替代减重策略的指南。持續體重減輕且這些藥物耐受良好的患者可受益於長期當這些藥物持續使用超過1年或停用之後,有時會觀察到體重恢復或額外新增。
由於各種因素,包括作用機制、减重效果和研究人群的差异,抗肥胖藥物對BP的長期影響喜憂參半。RCT顯示隨機分配至奧利司他、芬特明/托吡酯和利拉魯肽組的患者在1年時的BP較安慰劑組略有下降(SBP平均下降1-3mm Hg,DBP下降1-mm Hg;錶2),這被認為是由體重減輕介導的。或者,隨機分配接受納曲酮/安非他酮治療的患者與安慰劑治療的患者相比,RCT顯示BP輕微升高(平均,SBP升高2–mm Hg,DBP升高1–mm Hg)。值得注意的是,在長期使用抗肥胖藥物的RCT中,只有一部分參與者在基線時患有高血壓。對於已證明BP下降的减重藥物,在有潜在高血壓診斷的受試者分組中下降幅度略大(平均1mm Hg)。最近,作為生活方式治療的輔助手段,每週一次的司美格魯肽2.4mg皮下注射導致平均體重下降14.9%,SBP值從基線下降6.2–mm Hg至第68周。這種最初開發用於糖尿病治療的藥物顯示出較大的體重平均减少量和潜在較大的心臟代謝風險改善的前景,尤其是當與生活方式干預聯合使用時。
錶2與安慰劑相比,抗肥胖藥物治療在1年時體重和血壓的影響*
2.安全性和併發症
使用前,應告知患者抗肥胖藥物治療的潜在不良影響:
擬交感神經胺(如芬特明)最常見的副作用是便秘、頭暈、口幹和失眠。
還存在與作用機制相關的血壓升高的潛在風險,包括兒茶酚胺水准升高。儘管FDA標籤警告已準予用於長期减重的藥物(如芬特明/托吡酯聯合用藥)存在此風險,但在這些藥物的RCT中未觀察到BP的臨床顯著升高,這可能是由於伴隨的體重減輕所致。
奧利司他由於其外周作用機制而具有普遍良好的安全性。然而,當患者未嚴格遵守低脂肪飲食時,由於稀便、糞便尿急和腹瀉的發生率較高,囙此其耐受性通常較差。處方奧利司他的患者應服用多種維他命,因為脂溶性維生素的吸收减少。
Lorcaserin先前已獲FDA準予可長期用於减重,但由於在RCT的5年隨訪期間觀察到服用lorcaserin的患者中癌症(包括胰腺癌、結腸直腸癌和肺癌)的發生率高於安慰劑患者,囙此於2020年2月自願退出美國市場。
在對全國電子病歷數據樣本的分析中,Zhang等觀察到,在近200萬名符合條件的患者中,有
代謝手術
1.减重手術
2016年美國總共進行了216 000次MSs。袖狀胃切除術是最常見的代謝手術(58%),其次是Roux-en-Y胃旁路術(RYGB;19%),可調式胃束帶(3%),膽胰分流伴十二指腸轉流(0.6%).現時,> 98%的代謝手術是在腹腔鏡下進行的,代謝手術圍術期主要發病率
2.當前指征(美國)
BMI≥40 kg/m2或≥35 kg/m2伴合併症的患者,如果心理穩定且無活性物質濫用,則可作為MS的候選人。2型糖尿病伴BMI≥30 kg/m2(≥27.5 kg/m2的亞洲患者)的患者,如果在接受合理的藥物治療時血糖控制不佳,則可作為MS的候選人。MS應在有多學科團隊的中心進行,該團隊包括在以下方面具有專業知識的减重外科醫生、內分泌/糖尿病專家、心臟病專家、麻醉師、心理專家和營養師。
3.代謝手術(MetabolicSurgery)降低血壓的機制
MS後改善BP控制的機制似乎是多因素的、複雜的,目前尚未完全瞭解。BP降低最早發生在術後1周,即任何明顯的體重減輕之前,這表明神經內分泌機制發揮了作用。在各種類型的MS後,已觀察到腸促胰島素胰高血糖素樣肽-1的水准升高。胰高血糖素樣肽-1刺激餐後胰島素分泌,抑制胰高血糖素分泌,並具有幾個中樞作用,包括下咽。鑒於第四腦室的周圍器官之一後區含有胰高血糖素樣肽-1反應性兒茶酚胺能神經元,SNS可能與MS的BP降低效應有關。胰高血糖素樣肽-1可能對水和鹽的穩態很重要,高水准與鈉尿有關。利鈉肽也可能在MS誘導的BP改善中發揮作用;其迴圈濃度在肥胖患者中較低,在MS後升高。高血壓也可能受到白色脂肪組織分泌的多肽(即細胞因數(脂肪因數)、全身和腎臟炎症)變化的影響。最後,中心型肥胖個體的RAAS啟動新增,手術後可能恢復正常。
4.MS干預的臨床研究綜述
對觀察數據的系統回顧表明,MS可改善高血壓。一個實例(136項研究,22 094名患者)發現總體高血壓消退(resolution)63%,RYGB手術、可調節胃束帶和帶十二指腸開關的膽胰分流術的特定手術百分比分別為68%、43%和83%。在中比特10年隨訪時,來自SOS研究(瑞典肥胖受試者)的研究者觀察到,與接受非手術治療的對照受試者(接受RYGB治療的患者)相比,接受RYGB手術的患者的SBP和DBP均顯著降低對照受試者,1.2 vs -3.8mmHg;此外,與對照組相比,RYGB組接受抗高血壓藥物治療的患者百分比顯著降低(35% vs 53%;P6-mm Hg新增SBP和DBP)(RYGB組和對照組之間的所有比較均P
5.GATEWAY試驗
GATEWAY(胃繞道手術治療患有穩定期高血壓的肥胖患者;GastricBypass to Treat Obese Patients With Steady Hypertension)是唯一一項涉及MS的對照試驗,專門評估BP作為主要終點。在GATEWAY中,100名BMI值為30至39.9 kg/m2、接受過≥2種最大劑量降壓藥治療或> 2種中劑量降壓藥治療的患者按1:1的比例被隨機分配接受RYGB+藥物治療(n=50)或單獨藥物治療(n=50)。在第12個月時,主要結果,即在維持診室BP
6.安全性和併發症
自20世紀90年代引入微創手術以來,與MS相關的圍手術期發病率和死亡率顯著下降。美國全國住院患者樣本資料庫顯示,總住院發病率為9%,死亡率風險為0.1%。一項系統綜述報告稱,MS患者的圍手術期併發症發生率在10%-17%之間,30天死亡率為0.08%。MS的圍手術期併發症發生率與腹腔鏡膽囊切除術或腹腔鏡闌尾切除術或子宮切除術的圍手術期併發症發生率大致相當。
預防肥胖高血壓
預防體重增加和肥胖對於預防心臟代謝疾病至關重要,包括高血壓以及隨後的心臟、腎臟和腦部疾病。2-19歲兒童和青少年的肥胖症患病率為18.5%,2015年至2016年期間約有1370萬人受影響[96]。在兒童和青少年中,BMI的發病率升高與血壓升高密切相關。與保持健康體重的兒童相比,肥胖兒童發生高血壓的風險新增2倍,重度肥胖兒童發生高血壓的風險新增> 4倍。囙此,有必要做出全面和協調的努力,包括跨醫療保健系統、研究專案、文宣、教育、媒體和消費者組織的多學科戰畧[97]。其他因素,包括母親和父親的肥胖和高血壓、妊娠高血壓疾病和早發性肥胖的遺傳原因,可能在今後生活中肥胖高血壓的發生中起重要作用,是需要進一步研究的領域。
未回答的問題和未來方向
圖2和錶3說明了研究不足的領域和未回答的問題,並對未來方向提出了建議。
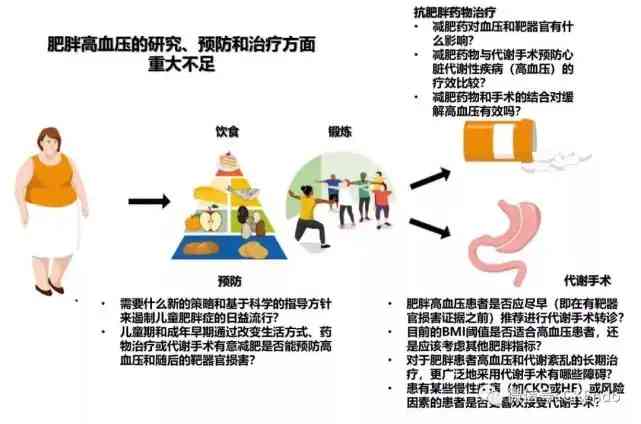
圖2在肥胖性高血壓的適當治療(飲食、新增體力活動、减少久坐、抗肥胖藥物治療和代謝外科手術)的研究和實施方面仍然存在重大不足。

結論
肥胖是導致高血壓以及隨後的心血管、腎臟和腦損傷的主要原因。體重減輕後血壓降低的機制可能主要是由介導血壓升高與體重增加的機制逆轉所致。然而,其中一些機制,如交感神經活性降低,似乎會隨著熱量攝入的减少而迅速逆轉,甚至在體重顯著減輕之前。有意識的减重策略,包括改變生活方式如飲食、新增PA和减少久坐,是降低肥胖個體血壓的重要方法,可降低高血壓和相關疾病的風險。然而,這些生活方式的改變對許多患者來說難以維持,體重恢復率也很高。藥物治療和MS等循證治療可用於治療肥胖,從而降低血壓。有短期和長期使用的减重藥物;然而,這些藥物的處方率仍然較低,可能是因為有限的保險範圍和臨床醫生治療肥胖症的水准較低。當對有高血壓風險或患有高血壓的個體開出抗肥胖藥物治療處方時,在確定治療方案時考慮作用機制很重要。MS是重度肥胖個體降低肥胖的有效長期方法。此外,MS對降低肥胖患者的血壓有短期和重要的長期影響。有必要進行額外的RCT,以評估MS對下游肥胖相關疾病(如慢性腎病、中風和心力衰竭)風險降低的影響。
參考文獻:Hall M E,Cohen J B,Ard J D,et al. Weight-Loss Strategies for Prevention and Treatment of Hypertension: A Scientific Statement From the American Heart Association[J]. Hypertension,2021: HYP. 0000000000000202.
評論留言