2021年10月1日,默沙東與Ridgeback公司聯合研製的一款口服抗病毒小分子藥物molnupiravir在III期臨床中期分析所呈現的數據喜人,囙此提前終止,並向美國食品藥品監督管理局(FDA)申請緊急使用授權(EUA)。
同時,默沙東公司預計到2021年底將生產1000萬個療程的藥物,且與多個仿製藥公司簽署協定以盡可能幫助中低收入國家的供應。
Photo Credit: Freepik
Molnupiravi的III期MOVe-OUT臨床試驗中期分析結果
本試驗是多中心、雙盲、隨機對照試驗,原計畫招募1550名患者,但是由於提前終止,目前為止共775名受試者。要求納入的患者需同時符合以下3條:COVID-19輕至中度症狀;至少有一個與病重相關的危險因素(如肥胖、高齡>60歲、糖尿病、心臟病等);且隨機分組時距離症狀出現的時間不超過5天。最終招募的受試者中,拉美人群占55%、歐洲人群占23%、非洲人群占15%,且約80%受試者為Delta、Gamma和Mu等突變株感染。
該試驗將主要指標設定為隨機分組後29天內住院或病死的患者百分比,結果發現:Molnupiravir組與對照組的病重或死亡率分別為7.3%(28/385)和14.1%(53/377)(p=0.0012)。本次試驗中共8名受試者死亡,但全部在對照組。也就是說,molnupiravir將進展為重症或死亡的幾率降低了50%,且將死亡率拉低至0%。
同時,molnupiravir的安全性也得到了證實:對於出現任何不良事件的百分比,molnupiravir組與對照組分別為35%和40%,出現藥物不良事件的百分比分別為12%和11%,均無統計學差异。出現因不良反應停止治療的比例分別為1.3%和3.4%,molnupiravir組明顯更低。

Molnupiravir膠囊
圖片來源:Open Access Government
雖然臨床結果的數據令人驚喜,但是對於臨床的應用仍存在一定不足:
第一,該臨床試驗只納入了輕至中度症狀的、有危險因素的、且症狀出現少於5天的新冠患者。因而,現時molnupiravir還不適用於出現症狀超過5天,或相對健康的群體(例如沒有基礎疾病的年輕人),或已經進展為重症的患者。
第二,緊急使用授權(EUA)的“通病”在於時間跨度不够長,囙此長期毒性無法評估,這只能等時間來驗證了。
第三,亞裔受試者數據不充足,對於中國患者相關的數據更是缺乏。囙此molnupiravir若用於中國新冠患者,臨床的數據是否還能這麼好現時不得而知。
FDA緊急使用授權結果預測
今年4月以來,美國疫情在經歷一波三折後終於有所好轉。然而,由於變異菌株的出現,疫情自今年7月以來再次抬頭,每日新增病例數仍居高不下。
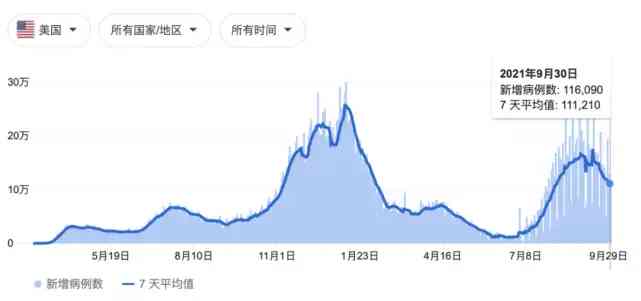
數據來源:紐約時報
那麼,在這樣的情况下,FDA對Molnupiravir未完成試驗,申請緊急使用授權的態度是什麼樣的?這就首先要談談美國防疫策略與中國的差別:
差別一,對於輕至中度的患者一般並不收入院也不強制隔離,治療上也僅在門診輸注單抗(例如casirivimab/imdevimab),且僅有症狀且不超過10天並合併危險因素的患者才符合使用單抗的條件。囙此,Molnupiravir大大降低了發展成為重症的幾率,很大程度上可以减少住院幾率,有效緩解醫療資源擠兌。
差別二,就全國而言,無論是單抗藥物(casirivimab/imdevimab),還是抗病毒藥remdesivir,都處於短缺狀態。所以,多一種藥物供選擇,百利無一害。
差別三,口服藥物與靜脈注射的價格差距很大,囙此第一款可以口服新冠藥molnupiravir的出現,無疑可以為政府减少一大筆醫療領域支出。
况且,molnupiravir的優點非常突出,尤其是對Delta、Gamma和Mu等變異菌株有效。
再者,美國自2020年末以來所使用的新冠疫苗(共三種:輝瑞、莫德納、强生的楊森)其實都是緊急使用授權。其中,輝瑞疫苗直到今年8月才正式批准適用於16歲以上人群,而另外兩種至今仍是緊急使用授權。
綜上分析,FDA很有可能通過緊急使用授。默沙東已於今年6月與美國政府簽署契约,若FDA給molnupiravir緊急使用授權,美國將購買170萬個療程的molnupiravir,這進一步說明FDA對molnupiravir十分看好。
若molnupiravir能够早日通過FDA的緊急使用授權,並保證對世界其他國家的供應,這對於全世界,尤其是其中可能進展成重症的患者,將是個福音。

Molnupiravir對世界疫情控制的影響預測
根據III期臨床試驗的受試者人群可以得到結論,molnupiravir只减少重症幾率,不防止感染。結合新冠病毒可以反復感染這一事實,理性分析其實可以得出結論:有了口服防重症的新冠藥物,攜帶病毒且自由活動的人其實只會更多,這可能會導致新冠病毒進一步的傳播。
試想,等到molnupiravir上市以後,新冠患者就醫時,若該患者符合用藥條件,那麼醫生開molnupiravir後會允許患者離開。這部分自由活動的患者就可能會將病毒傳播出去。
由於molnupiravir幫助病人不會進展成重症,囙此不需要住院隔離的病人會更多,從而導致更多人感染。接下來,新被感染的患者同樣也會去買藥、自由活動、傳播病毒。也就是說,molnupiravir的出現其實可能會導致新冠病毒更多的傳播。
人們的心理與行為也可能隨之改變,人們看待新冠會與看待其他疾病一樣,生病了買藥吃就行。在現今新冠如此猖獗、肆意掠奪人命的時候,還有大規模聚會並且不戴口罩的現象。等“救命藥”出現後,人們的行為變化可想而知。
囙此,在全世界大部分國家很有可能出現的情况是,人類不得不和病毒一直共存。這種情況會一直持續,直到病毒再次變異。到時若是沒有新的藥物或治療手段,疫情就會再爆發一次。亦或者科學人員發明了新藥能徹底殺死病毒,這場災難也可以結束。

總結來說,口服防重症藥物molnupiravir的出現,會使全世界新冠導致的重症或死亡病例减少,但是總體感染反而會增多。然而隨著感染基數增多,重症或死亡的病例總數會變多還是變少也不得而知。
所以,只靠個molnupiravir想要控制住疫情是不够的,疫苗、口罩和社交距離等防疫措施怕還是不能鬆懈下來。
參攷文章:
Deena Beasley. 2021. Merck to Seek FDA OK for Its COVID Pill After Trial Stopped Early. [online] MedScape. Available athttps://www.medscape.com/viewarticle/959950?uac=301446HN&faf=1&sso=true&impID=3678138&src=mkm_covid_update_210930_MSCPEDIT
撰文|小江豐
編輯| Jessica
評論留言