澤璟製藥一線晚期肝癌靶向藥多納非尼已經在上個月獲批上市,這是公司第一個商業化產品,也是首個國產晚期肝癌一線創新藥。
但是,早在多納非尼獲批前,晚期肝癌一線已是波濤暗湧,不僅降價一波接著一波,還有藝員免疫聯合療法強勢入局。如此一來,多納非尼的商業化前景毫無疑問也會面臨更大的挑戰。
就在去年底,索拉非尼(晚期肝癌一線靶向藥之一,為多納非尼的競品)將被納入國家集采的消息的傳出後,澤璟製藥還曾作出預測,認為索拉非尼的集采降價,可能會導致晚期肝癌一線靶向藥物存量市場降低6.10%~15.24%(按53%-59%的降幅計算),並對多納非尼的未來市場份額以及未來市場定價產生一定程度的影響。
現在,多納非尼終於要進場了,澤璟又打算如何爭得一席立足之地?
一線治療晚期肝癌哪家更强?
今年6月8日,澤璟製藥甲苯磺酸多納非尼片(簡稱:多納非尼,商品名:澤普生)獲國家藥監局(NMPA)準予上市,準予適應症為多納非尼單藥用於既往未接受過全身系統性治療的不可手術肝細胞癌患者的治療(一線治療晚期肝細胞癌)。
對於剛確診不能手術切除的中晚期肝癌患者來說,現時所能用的一線單藥方案有3個,除了多納非尼以外,還有拜耳的索拉非尼和衛材的侖伐替尼兩種選擇,均是小分子靶向藥。
另外,還有2個免疫組合療法,分別是羅氏的“T+A”組合(PD-L1免疫抑制劑阿替利珠單抗Tecentriq+貝伐珠單抗),以及信達生物的“雙達”組合(信迪利單抗注射液+貝伐珠單抗注射液)。
其中,拜耳索拉非尼是全球第一個上市的肝癌靶向藥物,也是晚期肝癌的經典藥物,於2008年7月在我國準予上市。2019年,索拉非尼中國區銷售額為13.5億元。
侖伐替尼是全球第二個晚期肝癌一線治療靶向療法,於2018年在中國獲批上市。2019年,侖伐替尼在中國區的銷售額為8.53億元。
多納非尼則是索拉非尼的的氘代衍生物,即按照同位素的原理,利用氘(D)替代了索拉非尼醯胺鍵上的甲基(-CH3)的氫(H)。有研究顯示,氘代化可能會改變藥物代謝,改善藥代動力學(PK),降低藥物代謝速度,有助於延長半衰期、降低毒性、改變分子手性或新增分子穩定性等,從而减少給藥頻率和劑量,同時提高生物活性、臨床療效、安全性和耐受性。
也就是說,多納非尼其實是一款結構跟索拉非尼非常相似的藥物,但在安全性和有效性有可能優於索拉非尼,可以看作是索拉非尼的“升級版”。
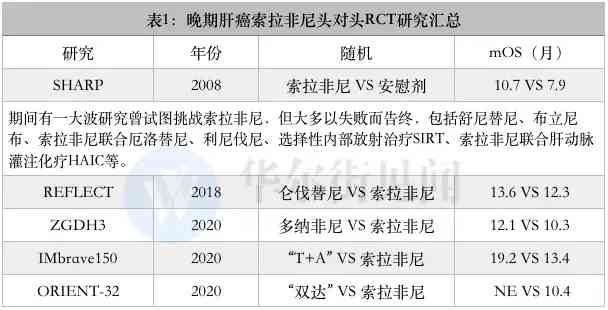
多納非尼獲批上市主要是基於其一線治療晚期HCC的多中心Ⅱ/Ⅲ期臨床研究(ZGDH3研究)。研究結果表明,多納非尼在主要療效中比特總生存期(mOS)和安全性方面均顯著優於對照組索拉非尼。
多納非尼VS索拉非尼的mOS(中比特生存期)是12.1個月VS 10.3個月,兩者相差了1.8個月;安全性方面,兩組的不良反應譜基本相似,多納非尼組顯示出較索拉非尼組更優的總體安全性趨勢。
並且,ZGDH3研究亞組分析顯示,在無門靜脈侵犯/肝外轉移的人群中,多納非尼最長mOS達到了21.7個月,提示如果臨床採用局部治療處理好門靜脈癌栓和肝轉移等問題,再聯合多納非尼,可能會得到比較好的全人群OS數據。
不過,雖然在與索拉非尼的PK中勝出,但侖伐替尼作為多納非尼的有力競爭者亦不可小覷,而兩個免疫聯合療法的臨床數據更是讓人驚豔。
其中,侖伐替尼與索拉非尼的頭對頭、一線治療不可手術切除晚期肝癌患者的大型III期臨床試驗(REFLECT研究)顯示,侖伐替尼組的總生存不劣於索拉非尼組,而無進展生存期、進展時間、客觀緩解率等其他名額均優於索拉非尼組。
侖伐替尼VS索拉非尼的mOS(中比特生存期)是13.6個月VS 12.3個月,研究達到非劣效終點。在次要研究終點分析上,侖伐替尼組均顯著優於索拉非尼組。兩組患者中比特無進展生存期(PFS)分別為7.3個月和3.6個月;中比特至疾病進展時間,侖伐替尼組與索拉非尼組分別為7.4個月和3.7個月。此外,侖伐替尼組的客觀緩解率(ORR)亦顯著高於索拉非尼組,兩組分別為40.6%和12.4%;疾病控制率(DCR)兩組分別分別為73.8%和58.4%。
值得一提的是,針對中國患者的亞組分析顯示,侖伐替尼OS顯著長於索拉非尼,達到優效。侖伐替尼的中比特總生存期是15個月,而索拉非尼只有10.2個月,提高了4.8個月。
兩個免疫組合療法中,羅氏“T+A”組合於2020年10月獲批。獲批的主要依據是III期臨床試驗IMbrave150的研究結果,該項研究包括對194名中國亞群患者的分析。2021年1月公佈的最新更新資料顯示,全球人群“T+A”組較索拉非尼組的mOS延長近半年(“T+A”:19.2個月,索拉非尼:13.4個月)。
“T+A”組的客觀緩解率(ORR)高達30%,顯著高於索拉非尼組(11%),其中“T+A”組有25例(8%)受試者達到完全緩解(CR)。而且,“T+A”組部分緩解(PR)率也更高(22% VS 11%)。
在194例中國人群亞組中,“T+A”組mOS達到突破性的24個月,相比對照組索拉非尼的11.4個月,生存延長了1年以上,而且降低了患者47%的死亡風險。
信達生物的“雙達”組合(信迪利單抗+貝伐珠單抗)於今年6月28日獲批。該組合的獲批是基於一項隨機、開放、III期對照臨床研究(ORIENT-32),主要研究終點是總生存期(OS)和無進展生存期(PFS)。
研究結果表明,“雙達”組合組和索拉非尼組的中比特總生存期(mOS)分別為未達到和10.4個月(NE VS 10.4個月),死亡風險顯著降低43%;中比特無進展生存期(mPFS)分別是4.6個月和2.8個月,疾病進展風險顯著降低44%。
多納非尼:定價最高只為國談?
中國是全球肝癌發病例數最多的國家。國際癌症研究機構(IARC)今年2月發佈的2020年全球最新癌症負擔數據報告顯示,2020年,我國肝癌新發410038例,占全球總例數(905677)的45.3%。
可即便中國有著最為龐大的肝癌患者人群,事實上,在今年以前,供患者選擇的藥物卻並不多,且治療負擔較重。因為在此之前,兩個晚期肝癌一線靶向藥中,侖伐替尼還不能醫保報帳,而索拉非尼雖然被納入醫保,但價格仍然不低。
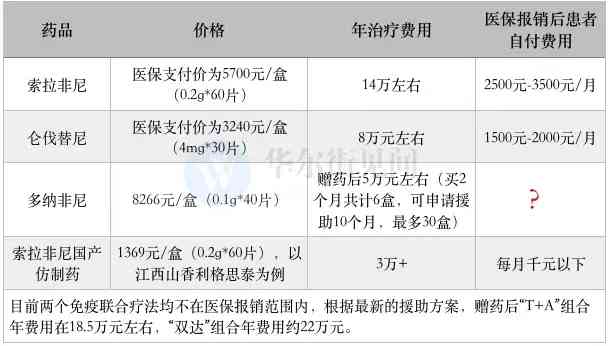
現時多吉美(拜耳原研索拉非尼)的醫保支付價為5700元/盒(0.2g*60片),用法用量為每次0.4g(0.2g*2),每日兩次,按照每個月2盒的用量計算,則醫保報帳後患者每個月的治療費用在2500~3500元左右(按70%-80%的醫保報帳比例計算,下同)。
不過,從今年起,隨著侖伐替尼進入醫保,以及索拉非尼的集采降價,情况開始好轉。
2020年12月,侖伐替尼通過醫保談判降價超80%納入醫保,醫保支付價於今年3月1日起執行。降價後的侖伐替尼為3240元/盒(4mg*30粒),按患者60kg體重計算,則每月需要2盒(共計6480元/月),醫保報帳後患者每個月的治療費用約為1500~2000元。
此外,索拉非尼還在今年2月初完成了國家帶量採購。不過原研拜耳並未得標,囙此拜耳索拉非尼仍將執行現有的醫保支付價。而兩家仿製藥企業—江西山香和複星醫藥控股子公司重慶藥友則降價76%和72%得標,報價分別為1369元/盒(0.2g*60片)和798元/盒(0.2g*30片),折算成單片價格為22.8元/片和26.6元/片。
囙此,如果使用江西山香的甲苯磺酸索拉非尼片(商品名:利格思泰)治療,則醫保報帳後患者每個月的治療費用降至千元以下。
多納非尼獲批上市後,其定價亦備受關注,因為在現時對手環伺的市場格局下,價格將在一定程度上影響多納非尼的“競爭力”。
對此,華爾街見聞瞭解到,多納非尼市場售價為8266元/盒(0.1g*40片)。多納非尼的用法是每次0.1g,每日兩次,按照患者每個月3盒的用量計算,治療費用為24798元/月。
對比索拉非尼還有侖伐替尼,這個價格顯然是偏高的,而公司如此定價也讓很多人倍感意外。
不過,根據國家醫保局日前公佈的《2021年國家醫保藥品目錄調整工作方案》,因為趕在2021年6月30日之前獲批,囙此多納非尼以及兩個免疫療法組合都有望參與今年的醫保談判。
加上侖伐替尼國內化合物專利將於2021年10月到期,國內仿製藥亦將陸續上市,囙此多納非尼可以說面臨著較大的醫保談判壓力,預計届時公司會努力降價以求儘快進入醫保,而此時的高定價或也是為了給之後的降價留下空間。
另外,從網傳資訊來看,多納非尼也推出了贈藥政策,具體為買2個月共計6盒,可申請援助10個月(最多30盒)。也就是說,贈藥後多納非尼的年治療費用可以降至5萬元左右(8266元/盒*6)。
雖然上市後的定價讓人“吐槽”不已,但另一方面,多納非尼的鋪貨進度卻相當神速。據報導,多納非尼6月9號準予上市,而6月12號就已經在一些藥店上架,並且當日有多家醫院同步開出首批處方單。
事實上,澤璟製藥在2020年上半年已經開啟行銷團隊的組建。公開資料顯示,澤璟製藥商業運營部由銷售、市場、醫學、商務及多元化等多個部門組成,各部門負責人均有多年的跨國藥企任職經歷與銷售經驗。其中,市場行銷副總裁丁偉在加入澤璟之前,曾在默沙東中國負責默沙東重磅PD-1抑制劑可瑞達的市場管理工作。
或許,也是因為深感競爭激烈,公司才轉而加碼行銷能力的提升。
評論留言