乳腺癌是全球發病率最高的一類癌症,年齡標準化發病率達到47.8/10萬。全球範圍內,每年有新發乳腺癌患者2261419例,我國每年新發乳腺癌患者416371例,占全球新發病人數18.4%1。
01
乳腺癌治療遵循以分子分型為基礎的分類治療原則。H0648g研究2證明,對於HER2過表達的乳腺癌,需要進行抗HER2治療。該研究促使曲妥珠單抗上市的同時,也讓乳腺癌的治療進入了分子靶向治療時代。HER2陽性乳腺癌患者組成了一個獨立的亞型,需要接受抗HER2靶向治療。
之後,多種不同作用機制的抗HER2靶向治療藥物相繼上市,包括靶向HER蛋白家族成員的小分子酪氨酸激酶抑制劑(TKI)拉帕替尼、吡咯替尼、奈拉替尼和圖卡替尼;單克隆抗躰(Ab):帕妥珠單抗、馬格妥昔單抗(margetuximab)以及抗體細胞毒偶聯藥物(ADC),T-DM1,T-Dxd。而且現時還有多種抗HER2靶向治療藥物的臨床試驗正在進行中。
曲妥珠單抗靶向HER2胞外段結構域,從而發揮抗腫瘤活性。囙此開展臨床研究需要篩選腫瘤細胞過表達HER2蛋白的患者,亦即HER2陽性患者。
回溯HER2陽性乳腺癌的定義,曲妥珠單抗獲批首個適應症的H0648g研究開展之前,研究者已發現HER2免疫組化結果與HER2擴增相關。但是以什麼樣的標準來定義HER2過表達人群並不確定。
囙此H0648g設計之初,允許HER2在整個腫瘤細胞膜呈弱至中度染色(IHC 2+)或超過10%的中度以上染色(IHC 3+)的患者入組。而最終的結果顯示,HER2 IHC3+患者的獲益較大3。基於此,後續曲妥珠單抗的臨床研究均以IHC3+(IHC2+且FISH陽性)為必要入組條件。
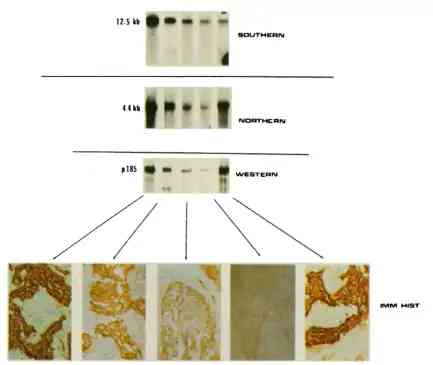
圖1:免疫組化結果與HER2基因擴增和蛋白過表達相關(圖源:參考文獻4)
基於此,FDA和ASCO/CAP製定HER2 IHC評估標準,將HER2免疫組化3+定義為:在>10%的腫瘤細胞中著色(ASCO/CAP曾經使用>30%偏保守標準,後改回10%),並且細胞膜染色完整、强烈。完整、强烈著色指的是HER2一定要過表達,10%指的是腫瘤組織中至少要有10%的癌症細胞HER2過表達,如此才有必要使用抗HER2靶向治療。至此,免疫組化這種半定量的管道成為篩選HER2陽性人群的主要方法。
2
但是,除了約20%的IHC3+患者之外,還有約80-70%的患者IHC0+,1+或2+。雖然可以通過FISH進一步篩選出部分HER2基因擴增的患者,但是剩下的這部分患者雖然被統稱為HER2陰性患者,但其腫瘤細胞表面也不同程度的表達HER2蛋白。然而,低表達HER2與患者長期預後是否相關並不明確4-6,這部分患者是否完全不能從抗HER2治療中獲益,也一直不能確定。
NSABP-B477研究是一項曲妥珠單抗在早期HER2陰性人群中開展的大型隨機對照臨床研究(RCT),研究將3270例已經完成化療的HER2低表達、高危、早期乳腺癌患者1:1隨機,試驗組接受曲妥珠單抗1年的治療,對照組正常隨訪。研究結果顯示,相比較對照組,曲妥珠單抗並沒有改善這部分患者的iDFS(兩組5年iDFS分別為86.6%和89.2%)。
拉帕替尼上市之初,嘗試在晚期一線HER2狀態不確定的患者中探索其有效性。研究共入組579例患者8,試驗組接受紫杉醇聯合拉帕替尼的治療,對照組接受安慰劑聯合紫杉醇的治療。研究結果顯示,在ITT人群中,相比較安慰劑,拉帕替尼並未顯著改善患者的PFS(HR 0.87,95% CI 0.72 -1.05 p = 0.142),亞組分析結果顯示,HER2陽性人群有一定獲益趨勢(HR 0.35,95% CI 0.31 -0.89 p = 0.0053),而HER陰性人群幾乎沒有獲益(HR 1.05,95% CI 0.84 -1.32 p = 0.6617)。
帕妥珠單抗的一項II期臨床研究9也嘗試在HER2低表達人群中探索其有效性和安全性,研究共入組79例晚期HER2陰性乳腺癌患者,分別使用帕妥珠單抗常規劑量和高劑量進行治療,研究結果顯示,無論是常規劑量還是高劑量,均沒有對這部分患者帶來明顯的獲益。這些陰性的結果似乎再次強調,所有的抗HER2治療藥物都應該用於HER2陽性的乳腺癌患者,直到另外一個II期臨床研究的結果帶來了新的資訊。
3
這項II期臨床研究使用一種新型的抗HER2靶向治療藥物——T-DXd,研究共入組54例既往化療進展的後線HER2低表達患者(HER2 IHC2+且FISH陰性或IHC1+),使用T-Dxd單藥治療,結果顯示,ORR達到37.0%(95% CI 24.3%-51.3%),中比特PFS達到11.1個月(95% CI 7.6 -NE),研究結果提示,對於HER2低表達的晚期乳腺癌人群,單藥使用T-DXd是一個值得探索的治療方案。
這兩項研究都是開放、III期的隨機對照臨床研究,計畫入組晚期HER2低表達乳腺癌患者。不同的是DESTINY-Breast 04入組患者HR狀態不限,但是DESTINY-Breast 06入組患者必須是HR陽性。
兩項研究試驗組接受T-DXd單藥治療,對照組接受醫生選擇的化療方案。主要終點是BICR評估的無進展生存期(PFS)。兩項研究均入組後線患者,未能探討其中HR陽性患者聯合使用CDK4/6i的方案,有點遺憾。我們期待這樣的III期研究可以為HER2低表達人群使用抗HER2治療藥物帶來更多的資訊。
圖2:DESTINY-Breast 04研究和DESTINY-Breast 06設計(圖源:作者)
另外,Clinical Trial上的登記資訊顯示,T-DXd已經在開展聯合免疫檢查點抑制劑用於HER2低表達人群的II期臨床研究。如果結果陽性,那麼三陰性乳腺癌患者中有望分出一部分HER2低表達患者,可以從抗HER2治療中獲益。
研究者分析了為什麼T-Dxd可以讓HER2低表達人群獲益10,大體原因有以下四點:
其一,T-Dxd荷載更多的細胞毒藥物,藥物抗體比可達8:1;
其二,T-Dxd細胞毒藥物和單克隆抗躰連接子可切割,細胞毒藥物可於腫瘤微環境中釋放,殺傷HER2陰性乳腺癌細胞;
其三,已經死亡的腫瘤細胞會釋放細胞毒藥物到腫瘤微環境,繼續發揮抗腫瘤作用;
其四,荷載的拓撲異構酶抑制劑類細胞毒藥物並不會被乳腺癌既往治療中使用,囙此晚期乳腺癌細胞往往對其敏感。
基於以上原因,T-Dxd可以發揮有效、安全的旁觀者致死效應,從而對HER2低表達患者產生作用。
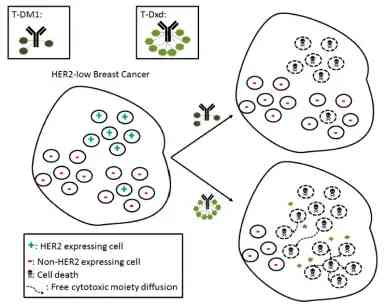
圖3:T-Dxd的旁觀者致死效應機制(圖源:參考文獻11)
從現時的研究趨勢看,除了ADC藥物可以讓HER2低表達人群獲益外,在研的其它抗HER2治療藥物也在探索針對HER2低表達人群的有效性。雙特异性抗體允許腫瘤和免疫細胞之間的強制連接和/或抑制多個訊號通路,在HER2低表達的乳腺癌細胞中具有潜在活性。
另外,針對HER2蛋白開發的腫瘤免疫疫苗也會啟動患者體內針對HER2蛋白的免疫反應,而這種免疫反應也會一定程度促進HER2低表達甚至陰性的癌症細胞被免疫系統清除。現時已經在輔助治療中開展研究,以期降低HER2低表達乳腺癌的復發和轉移。
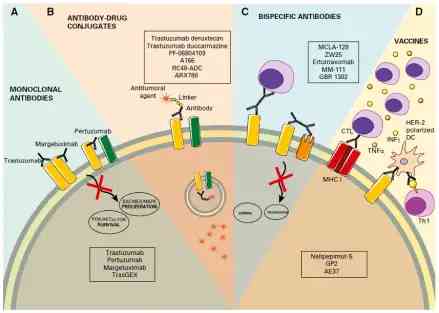
圖4:新型抗HER2藥物通過不同的機制靶向HER2低表達癌症(圖源:參考文獻12)
4
隨著越來越多不同作用機制藥物的研發,以及已經上市藥物對HER2低表達人群的探索,可以預見,將來乳腺癌以分子分型為基礎的分類治療將會發生變化,適合抗HER2靶向治療的患者將會變多。HER2低表達人群約占乳腺癌總人群的50%左右。
一項發表於lancet oncology的回顧性分析11,將2310例HER2陰性接受新輔助化療的乳腺癌患者進行分析,結果發現約60%的HR陽性乳腺癌患者同時HER2低表達,而三陰性乳腺癌患者中約有33%的乳腺癌患者HER2低表達。對於這部分患者,怎樣將抗HER2治療結合到現時的標準治療中將會需要多項臨床研究進行探索。例如:
對於HR陽性晚期乳腺癌中HER2低表達的患者,是否可以聯合CDK4/6i和抗HER2治療?
對於晚期三陰性乳腺癌中HER2低表達的患者,是否可以聯合免疫檢查點抑制劑和抗HER2治療?
免疫治療聯合哪種抗HER2治療藥物才能發揮協同作用?等等。
現時2021 CSCO乳腺癌指南新增HER2低表達乳腺癌的定義:HER2 IHC2+且FISH陰性或IHC1+12,希望指南定義的明確可以指導後續臨床研究的開展。
不過,無論產生多少問題,顯然乳腺癌患者可以使用的藥物越來越多,而在原有分類治療基礎上再進一步進行細分是一種必然的趨勢。每一個乳腺癌患者囙此都將會接受最有效、最安全、最適合自己的個體化治療。
專家點評

乳腺癌HER2低表達與HER2過表達、HER2零表達相比,HER2低表達腫瘤具有獨特的生物學特徵,在治療和預後反應方面存在差异。
隨著HER2低表達臨床試驗結果的公佈預示著HER2低表達時代的到來,乳腺癌分子分型將會更加豐富和完善,HER2低表達亞型的患者將會得到更加精准的治療,這將為HER2低表達人群預後的改善提供新的機會。
現時,ASCO已經公佈了DESTINY-Breast系列研究數據,這意味著HER2低表達靶向治療藥物的研發有了突破性的進展,相關結果顯示DS-8201能够極大地提高HER2低表達人群的客觀緩解率並改善患者的無進展生存時間。HER2低表達亞型將會成為乳腺癌新的生物學亞型,針對該亞型的治療藥物和方案也將逐漸清晰。
囙此,針對首診的乳腺癌患者,無論是早期患者還是晚期患者,作為臨床醫生需要進一步明確HER2的表達水准,明確患者屬於HER2過表達、低表達或是零表達。
尤其是晚期患者,如果確定HER2低表達可以首選推薦患者入組HER2低表達靶向治療的相關臨床試驗,目前國內已經開展的針對HER2低表達晚期乳腺癌的臨床試驗有10餘項,已經開始入組患者並開始進行了相關的抗HER2低表達靶向治療,我們期待相關研究結果的公佈,這將為臨床實踐指南的更新提供更多循證醫學證據。
對於早期患者能够更加詳細的確定分子亞型,隨著晚期患者數據的公佈,抗HER2低表達靶向藥物的療效已經得到證實,將會設計針對HER2低表達早期乳腺癌患者的臨床研究,為HER2低表達患者的(新)輔助治療提供相應的治療策略。
總之,HER2低表達亞型的確定將是未來的趨勢,HER2靶向治療的策略將會更加豐富,HER2低表達人群的治療療效將會得到極大提升,預後也將得到明顯改善。
本文僅供醫療衛生等專業人士參攷
策劃:GoEun,梅浙
題圖來源:站酷海洛PLUS
參考文獻:
[1]. International Agency for Research on Cancer 2020,World Health Organization(https://gco.iarc.fr/today/home);
[2]. Slamon DJ,Leyland-Jones B,et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001 Mar 15;344(11):783-92.
[3]. Smith IE. Efficacy and safety of Herceptin in women with metastatic breast cancer: results from pivotal clinical studies. Anticancer Drugs. 2001 Dec;12 Suppl 4:S3-10.
[4]. Slamon DJ,Godolphin W,et al,Press MF: Studies of the HER2/neu proto-oncogene in human breast and ovarian cancer. Science 1989;244:707–712.
[5]. Gilcrease MZ,Woodward WA,Nicolas MM,et al: Even low-level HER2 expression may be associated with worse outcome in node-positive breast cancer. Am J Surg Pathol 33:759-767,2009
[6]. Birner P,Oberhuber G,Stani J,et al: Evaluation of the United States Food and Drug Administration-approved scoring and test system of HER-2 protein expression in breast cancer. Clin Cancer Res 7:1669-1675,2001
[7]. Camp RL,Dolled-Filhart M,King BL,et al: Quantitative analysis of breast cancer tissue microarrays shows that both high and normal levels of HER2 expression are associated with poor outcome. Cancer Res 63:1445-1448,2003
[8]. Fehrenbacher L,Cecchini R,Geyer C,et al: Abstract GS1-02: NSABP B-47(NRG oncology):Phase III randomized trial comparing adjuvant chemotherapy with adriamycin(A)and cyclophosphamide(C)weekly paclitaxel(WP),or docetaxel(T)and C with or without a year of trastuzumab(H)in women with node positive or high-risk node-negative invasive breast cancer(IBC)expressing HER2 staining intensity of IHC 1+ or 2+ with negative FISH(HER2-Low IBC). Cancer Res 78:GS1-02-GS1-02,2018(4 suppl)
[9]. Di Leo A,Gomez HL,et al. Phase III,double-blind,randomized study comparing lapatinib plus paclitaxel with placebo plus paclitaxel as first-line treatment for metastatic breast cancer. J Clin Oncol. 2008 Dec 1;26(34):5544-52.
[10]. Gianni L,LladóA,et al. Open-label,phase II,multicenter,randomized study of the efficacy and safety of two dose levels of Pertuzumab,a human epidermal growth factor receptor 2 dimerization inhibitor,in patients with human epidermal growth factor receptor 2-negative metastatic breast cancer. J Clin Oncol. 2010 Mar 1;28(7):1131-7.
[11]. Eiger D,Agostinetto E,et al. The Exciting New Field of HER2-Low Breast Cancer Treatment. Cancers(Basel). 2021 Mar 1;13(5):1015.
[12]. Tarantino P,Hamilton E,et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol. 2020 Jun 10;38(17):1951-1962.
[13]. Denkert C,Seither F,et al. Clinical and molecular characteristics of HER2-low-positive breast cancer: pooled analysis of individual patient data from four prospective,neoadjuvant clinical trials. Lancet Oncol. 2021 Aug;22(8):1151-1161.
[14]. Guidelines of chinese society of clinical onclogy breast cancer. Beijing: People's Medical Publishing House,2021.
評論留言