腫瘤免疫療法已經在全球範圍內掀起了一波又一波的熱浪,其中,以免疫檢查點抑制劑(PD-1/PD-L1抑制劑等)及細胞療法(CAR-T細胞療法等)最為熱門。
然而,現有的免疫療法多集中於“復活”T細胞殺傷腫瘤的活性,但巨噬細胞作為免疫反應的“關鍵執行者”,在癌症免疫治療中也發揮著重要的作用,並表現出廣闊的發展前景。
近期,來自美國佐治亞州亞特蘭大佐治亞州立大學的科學家,在Nature子刊中發佈了一項開創性研究。這項研究開發了一種基於巨噬細胞的新型免疫療法,可有效治療多種晚期癌症。作者提出,在放療聯合治療策略中,機體內訊號調節蛋白α(SIRPα)缺陷的巨噬細胞表現出强大的抗腫瘤活性,在自身殺傷腫瘤細胞的同時,還將啟動體內的T細胞,並為其創造了有利的“殺瘤微環境”[1]。

圖1: Intratumoral SIRPα-deficient macrophages activate tumor antigen-specific cytotoxic T cells under radiotherapy
“SIRPα蛋白”為何有這樣的療效?
SIRPα又稱SHPS-1或SIRPΑ,它包含3個Ig樣結構域、1個跨膜區和胞質區內的4個酪氨酸殘基,形成兩個典型的免疫受體酪氨酸抑制基序(IT-IMS)。SIRPα是一種通過細胞質區域與酪氨酸磷酸酶SHP-1和SHP-2結合的跨膜蛋白,主要表達於神經元、樹突狀細胞和巨噬細胞,其胞漿區可觸發級聯反應,從而抑制巨噬細胞對腫瘤細胞的吞噬[2]。
而腫瘤細胞表面的CD47可與巨噬細胞表面的抑制性免疫受體——SIRPα相結合,形成CD47-SIRPα訊號複合體,該複合體能抑制巨噬細胞對腫瘤細胞的吞噬,使腫瘤細胞逃避免疫監視,從而促進腫瘤的發展。
有學者戲稱,位於腫瘤細胞表面的CD47有如“綠茶婊”,向巨噬細胞表面的SIRPα發送“別吃了我(Don‘t eat me)”的訊號,從而瞞天過海實現免疫逃逸。囙此,破壞腫瘤細胞和巨噬細胞之間CD47-SIRPα的相互作用是一種有效的抗腫瘤策略。近年來CD47單抗、SIRPα-Fc融合蛋白以及核酸類藥物已成為抗腫瘤新藥研發的熱點。
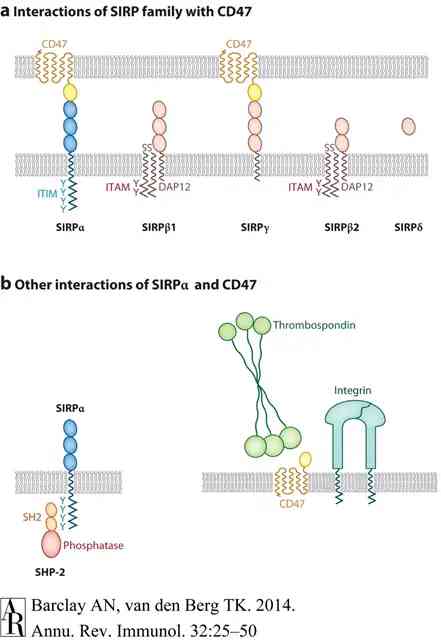
圖2: CD47-SIRPα訊號複合體圖解[2]
靶向SIRPα治療新思路——改造巨噬細胞
多年來,針對CD47-SIRPα複合體的腫瘤免疫治療思路,多集中於開發抗體或抑制劑類藥物,即開發新的免疫檢查點抑制劑療法,也陸續開展了許多1期、2期臨床試驗,鮮少有科學家直接聚焦於巨噬細胞本身。
而近期發佈的這項最新研究,之所以稱其為“開創性研究”,在於該文作者針對CD47-SIRPα複合體的腫瘤免疫治療思路彙聚於巨噬細胞本身,通過改造巨噬細胞,實現對CD47-SIRPα複合體的根源性阻斷。
作者提出,在實體瘤的治療中,放射治療(RT)長期以來一直被認為是其治療的“中流砥柱”。在最好的情况下,放療不僅可以消除受照射部位的腫瘤,還可以誘導機體遠端效應,通過啟動機體內抗腫瘤CD8+T細胞,即CTL細胞來幫助患者清除遠端轉移灶。但遺憾的事,僅有少數患者能够幸運的引發這種遠端效應,在臨床環境中並不多見。大多數放療策略,即使與PD-1/PD-L1抑制劑聯用,也無法誘導機體產生足够强的免疫應答,來消滅遠端轉移的腫瘤細胞,尤其是在腫瘤體積大、免疫原性差和/或具有極强的抑制性免疫微環境時。
囙此,為了改善現有的治療窘境,我們急需進一步瞭解腫瘤細胞如何抵抗放療的機制,同時開發增强放療誘導的免疫應答創新療法。
SIRPα缺陷的巨噬細胞免疫療法,抗癌療效好且副作用小
有研究發現,當SIRPα缺陷的巨噬細胞被某些促炎細胞因數或TLR激動劑啟動時,無論腫瘤細胞表面的CD47表達如何,它們都顯示出快速吞噬腫瘤細胞的强大能力。
在該研究中,研究人員首先構建體內結腸癌模型(MC38),隨後用基於SIRPα缺陷的巨噬細胞療法來治療癌症,驗證該細胞療法的治療效果。研究發現,局部放化療治癒了患有晚期腫瘤的SIRPα缺陷小鼠的結直腸癌;而且接受治療的患癌小鼠,並無明顯不良反應;還表現出與健康小鼠相似的正常壽命(約18個月),且研究發現,小鼠體內的免疫微環境呈現為巨噬細胞、NK細胞、CTL細胞、中性粒細胞高度浸潤的“殺瘤微生態”。
囙此,作者認為,該結果說明通過SIRPα缺陷基因的治療,巨噬細胞可通過引發炎症和啟動腫瘤特异性T細胞,啟動針對癌症的强大免疫反應,並可最大限度的降低對健康細胞的不利影響。
另外,為了確定經治療後的SIRPα缺陷小鼠體內是否存在長期抗腫瘤免疫是,研究人員對“癌症康復”的SIRPα缺陷小鼠進行了腫瘤再移植試驗,即將MC38細胞(小鼠結腸癌細胞)重新接種到小鼠體內。令人驚喜的是,癌細胞並未在小鼠體內增殖擴散。說明這種基於巨噬細胞的新型免疫療法,不僅可以短期治療癌症,還可以讓小鼠獲得長期的抗腫瘤免疫能力。
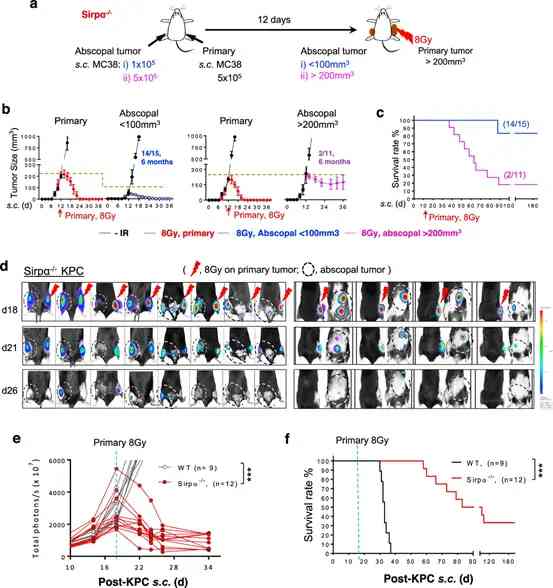
圖3: SIRPα缺陷小鼠表現出RT誘導的遠隔效應和持久的抗腫瘤免疫
簡而言之,該研究發現,SIRPα是放療後機體內腫瘤微環境免疫改變的“操盤手”,針對SIRPα缺陷的免疫治療,與放化療相結合,或可成為一種泛癌治療策略,作者認為:“這種療法,在未來可成為指引人類對抗所有癌症的燈塔!”
靶向CD47-SIRPα腫瘤免疫療法未來可期
實際上,現時已經開發出許多能够特异性阻斷癌症CD47-SIRPα訊號的抑制劑,包括抗CD47單克隆抗躰、重組融合蛋白、雙特异性抗體等。對於CD47-SIRPα阻斷劑研究較為深入的包括Hu5F9-G4(Forty-Seven)、CC-90002(Celgene)、TTI-621(Trillium)、ALX148(Alexo Therapeutics)、SRF231(Surface Oncology)、SHR-1603(恒瑞)和IBI188(Innovent Biologics)等。
值得關注的是,2020年美國血液學會(ASH)大會公佈了CD47抗體Magrolimab(Hu5F9-G4)聯合化療藥阿紮胞苷(AZA)治療骨髓增生异常綜合征(MDS)與急性骨髓性白血病(AML)的最新臨床進展。結果顯示,Magrolimab+AZA聯合治療在該適應症上展現了永續的療效。對於高危MDS患者(平均隨訪時間為6.4個月),其客觀緩解率(ORR)為92%(22/24),完全緩解率(CR)為50%(12/24);對於不適合化療、未經治療的AML患者(平均隨訪8.8個月),ORR為64%(14/22),CR為41%(9/22);可以說,這是結果是令人振奮的。
然而,CD47-SIRPα通路相關藥物開發,還涉及許多問題,如聯合用藥。有學者認為,如何將其協同作用的療效發揮至最高,將不良反應降至最低,如何研發出同時具有兩者療效的藥物品種,如何設計出最佳給藥管道是接下來需要研究的重點[3]。
參考資料:
1. Bian,Z.,et al.,Intratumoral SIRPα-deficient macrophages activate tumor antigen-specific cytotoxic T cells under radiotherapy. Nat Commun,2021. 12(1):p. 3229.
2. Barclay,A.N. and T.K. Van den Berg,The interaction between signal regulatory protein alpha(SIRPα)and CD47: structure,function,and therapeutic target. Annu Rev Immunol,2014. 32: p. 25-50.
3.楊琴and劉曉波,CD47-SIRPα阻斷劑在實體癌和血液癌中的研究現狀.動物醫學進展,2020. v.41;No.320(02):p. 108-112.
評論留言